Point isobestique
Un point isobestique se trouve à une longueur d'onde spécifique à laquelle deux espèces chimiques possèdent la même absorbance molaire en spectroscopie.
Recherche sur Google Images :
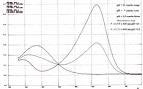
Source image : www4b.ac-lille.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- La stéréochimie de la réaction est par conséquent spécifique et se produit avec.... Noter que la longueur d'onde du point isobestique est proche de 500 nm pour le ... (source : marsal.univ-tln)
- Etude de la variation de la constante de vitesse k d'une réaction...... Noter que la longueur d'onde du point isobestique est proche de 500 nm pour le ... (source : ayellouda.ifrance)
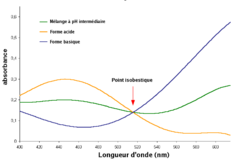
Un point isobestique se trouve à une longueur d'onde (λ) spécifique à laquelle deux (ou plus) espèces chimiques possèdent la même absorbance molaire (ε) en spectroscopie. Ce point représente une coordonnée (λ, ε) sur un diagramme isobestique pour laquelle le spectre d'absorption de deux espèces se croisent, cette dernière affirmation n'étant vérifiée que si les absorptions molaires sont représentées (au lieu des absorbances). En d'autres termes, le point isobestique est une longueur d'onde pour laquelle ces substances ont le même cœfficient d'extinction.
Deux substances peuvent avoir plusieurs points isobestiques dans un même spectre.
Pour la réaction :
la concentration analytique est la même en tout point :
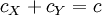 .
.
L'absorbance du mélange réactionnel (reconnue comme ne dépendant que de X et Y) est :
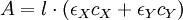 .
.
Or au point isobestique, les deux absorptivités molaires sont semblables :
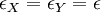 .
.
Donc, l'absorbance
ne dépend pas de l'amplitude de la réaction (i. e. pour les concentrations spécifiques de X et Y).
Applications
En cinétique chimique, les points isobestiques sont utilisés comme points de référence dans l'étude des taux de réaction, l'absorbance à ces longueurs d'ondes étant constante tout au long de la réaction. De même, si le mécanisme d'une réaction suivie spectroscopiquement est inconnu, l'observation d'un point isobestique prouve qu'il s'agit d'une réaction en une étape se traduisant par du composé de départ en un produit d'arrivée (ou un mélange de produit d'arrivée dans des proportions fixes).
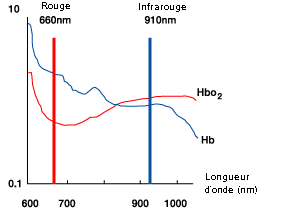
Les points isobestiques sont utilisés en médecine dans une technique de laboratoire nommée oxymétrie pour déterminer la concentration en hémoglobine, sans se soucier de sa saturation. L'oxyhémoglobine et la désoxyhémoglobine ont des points isobestiques à 590 et 805 nm.
Les points isobestiques sont aussi utilisés en biochimie clinique, comme méthode d'assurance qualité, pour vérifier la précision sur une longueur d'onde d'un spectrophotomètre. Cela est réalisé en mesurant le spectre d'une substance étalon pour deux conditions pH différentes (en-dessus et au-dessous du pKa du composé). Les substances utilisées comme standard comprennent le dichromate de potassium (points isobestiques à 339 et 445 nm), le bleu de bromothymol (325 et 498 nm) et le rouge congo (541 nm). La longueur d'onde déterminée pour un point isobestique ne dépend pas de la concentration du composé utilisé et , comme tel, il devient ainsi une référence particulièrement fiable
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Isosbestic point».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

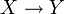
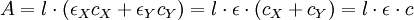

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité