Série de Lyman
La série de Lyman correspond à l'ensemble des transitions électroniques des états excités de l'atome d'hydrogène vers son état essentiel et se traduit par l'émission d'une série de longueurs d'ondes en physique.
Recherche sur Google Images :

Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- 1 - Formation du spectre de raies - spectre de l'atome d'hydrogène... dans le domaine visible du spectre, quoiqu'elles aillent en se resserrant vers... limite de la série de Lyman) est susceptible d'ioniser l'atome d'hydrogène dans ... (source : books.google)
- ... 3 - Le spectre de raies renseigne sur la composition chimique et la température... visible du spectre, quoiqu'elles aillent en se resserrant vers... la limite de la série de Lyman) est susceptible d'ioniser l'atome... (source : acces.inrp)
- Cette lumière peut être décomposée par un spectroscope en un spectre (un "arc en ... 343 mille, 639 Hz. La série de Lyman est par conséquent la série de fréquences de .... L'onde élastique se propageant de l'extérieur vers le centre (flèche... (source : pagesperso-orange)
La série de Lyman correspond à l'ensemble des transitions électroniques des états excités (n ≥ 2) de l'atome d'hydrogène vers son état essentiel (n = 1) et se traduit par l'émission d'une série de longueurs d'ondes en physique.
Le nombre n est le nombre quantique principal désignant le niveau d'énergie de l'électron. Les états de transitions sont appelés par des lettres grecques :
| Transition | Notation de Lyman | Notation de Siegbahn | Notation IUPAC |
|---|---|---|---|
| de n = 2 vers n = 1 (couche L vers couche K) |
α-Lyman | Kα | K-L? |
| de n = 3 vers n = 1 (couche M vers couche K) |
β-Lyman | Kβ1 | K-M3 |
| de n = 4 vers n = 1 (couche N vers couche K) |
γ-Lyman | Kβ2 | K-N? |
| … | |||
La première raie du spectre ultraviolet (UV) de la série de Lyman fut découverte en 1906 par un physicien de Harvard Theodore Lyman qui étudiait le spectre UV en électrisant des molécules d'hydrogène. Le reste des raies du spectre fut découvert par ce même chercheur entre 1906 et 1914.
Le spectre de radiation émis par l'hydrogène est non continu. On retrouve ici une illustration de la première série de raies émises par l'hydrogène :
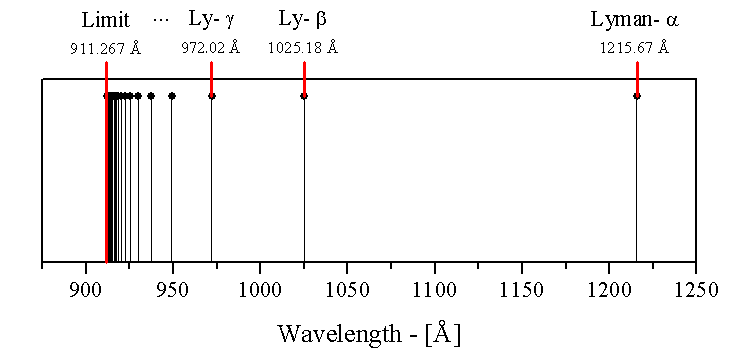
Historiquement, l'explication de la nature d'un tel spectre posa de sérieux problèmes en physique, personne ne pouvait prédire la longueur d'onde du spectre de l'hydrogène jusqu'à ce que Johannes Rydberg propose une formule empirique qui résout le problème en 1888. Il testa plusieurs formules afin d'en trouver une correspondant aux raies connues. Il put alors prédire les raies non toujours découvertes avec cette même formule :
où n est un entier naturel supérieur ou identique à 2.
Ainsi par conséquent, les raies observées correspondent à des longueur d'onde telles que n = 2 jusqu'à n = 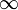 de gauche à droite.
de gauche à droite.
Les longueurs d'ondes en nanomètres (nm) dans la série de Lyman sont :
| Transition | longueur d'onde | |
|---|---|---|
| 2-1 | : | 121, 5 |
| 3-1 | : | 102, 5 |
| 4-1 | : | 97, 2 |
| 5-1 | : | 94, 9 |
| 6-1 | : | 93, 7 |
| 7-1 | : | 93, 0 |
| 8-1 | : | 92, 6 |
| 9-1 | : | 92, 3 |
| 10-1 | : | 92, 1 |
| 11-1 | : | 91, 9 |
| Limite : 91, 15 nm | ||
Voir aussi
Source
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Lyman series».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité