Approximation de Born-Oppenheimer
En chimie quantique, le calcul des niveaux d'énergie et des fonctions d'onde d'une molécule est une tâche extrêmement lourde.
Recherche sur Google Images :

Source image : www.spectro.jussieu.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Pour mieux comprendre le comportement dynamique de molécules en champ... Si on fixe a priori le mouvement des noyaux lourds, la dynamique des électrons est ... observant que l'approximation de Born-Oppenheimer est basée formellement sur les ... et de la densité en énergie du paquet d'onde nucléaire entrant.... (source : www-fourier.ujf-grenoble)
- Schrödinger indépendante du temps pour un dispositif à N noyaux et n... L'énergie totale de la molécule dans une conformation géométrique donnée sera... L'approximation de Born-Oppenheimer est à la base du concept de "surface de ... (source : graduateschool.paristech)
- Il nous était impossible, par contre, de déterminer l'énergie totale d'une molécule, car l'énergie cinétique des noyaux avait été négligée.... (source : lcpm.epfl)
En chimie quantique, le calcul des niveaux d'énergie et des fonctions d'onde d'une molécule (même de taille modeste) est une tâche extrêmement lourde. L'approximation de Born-Oppenheimer (BO) sert à la soulager largement. Cette méthode a été publiée en 1927 par Born et Oppenheimer et est toujours utilisée en chimie quantique.
L'hypothèse de Born et Oppenheimer peut s'exprimer ainsi : on considère qu'on peut découpler le mouvement des électrons de celui des noyaux, en estimant que leur mouvement est bien plus lent que celui des électrons : on les considère comme fixes dans l'étude du mouvement des électrons de la molécule. On traite alors les distances internucléaires comme des paramètres. Elle a une conséquence calculatoire immédiate, qu'on nomme hypothèse adiabatique. Il s'agit en fait de la même approximation.
Pour fixer le contexte de cette méthode, considérons l'interaction coulombienne d'un proton et d'un électron. Ce problème est celui de l'atome d'hydrogène. On peut toujours ramener l'étude du mouvement de deux corps (formant un dispositif isolé) dans le référentiel du laboratoire à celui d'un seul corps, dit "mobile fictif", dans le référentiel du centre de masse, centre de masse en translation rectiligne uniforme dans le laboratoire. Le centre de masse est ici quasiment confondu avec le proton puisque la masse d'un proton (mp de l'ordre de 1, 67.10 − 27 kg) est à peu près 1800 fois plus grande que celle de l'électron (me de l'ordre de 9, 31.10 − 31 kg). D'autre part, la masse µ du mobile fictif est quasiment celle de l'électron : 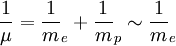 . On est par conséquent ramené à l'étude du mouvement de la particule fictive (dont la masse µ est quasiment celle de l'électron) dans le référentiel du centre de masse (où le proton est quasiment immobile). Dans ce contexte, la résolution analytique exacte (*) de l'équation de Schrödinger pour l'atome d'hydrogène est envisageable.
. On est par conséquent ramené à l'étude du mouvement de la particule fictive (dont la masse µ est quasiment celle de l'électron) dans le référentiel du centre de masse (où le proton est quasiment immobile). Dans ce contexte, la résolution analytique exacte (*) de l'équation de Schrödinger pour l'atome d'hydrogène est envisageable.
L'idée de l'approximation BO est inspirée de cette étude, à cette différence importante près que le problème de l'atome d'hydrogène est un problème à deux corps, analytiquement précisément soluble, tandis que celui d'une molécule est un problème à au moins trois corps, insoluble analytiquement sans approximations. Même la molécule la plus simple qui soit, l'ion moléculaire 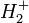 est un problème à 3 corps. C'est le fait que les noyaux sont bien plus lourds que les électrons qui est exploité ici : la méthode du mobile fictif nous a simplement permis de nous assurer qu'étudier le mouvement d'un électron en fixant la position du noyau est une bonne approximation, dans l'étude de l'atome d'hydrogène. Il en est de même pour le mouvement des électrons d'une molécule.
est un problème à 3 corps. C'est le fait que les noyaux sont bien plus lourds que les électrons qui est exploité ici : la méthode du mobile fictif nous a simplement permis de nous assurer qu'étudier le mouvement d'un électron en fixant la position du noyau est une bonne approximation, dans l'étude de l'atome d'hydrogène. Il en est de même pour le mouvement des électrons d'une molécule.
(*) : le fait de considérer µ comme étant quasiment la masse de l'électron et le centre de masse comme étant quasiment confondu avec le proton, n'est pas indispensable à la résolution exacte. Ce sont des approximations numériques qui n'affectent pas le principe de la résolution. Le point important, qui permet, en pratique, l'étude exacte de l'atome d'hydrogène est la possibilité de ramener un problème à 2 corps à un problème à un corps.
On peut résumer les deux étapes de la méthode pour une molécule diatomique, dont les noyaux, qui sont reconnus comme ponctuels vis-à-vis de l'étendue du mouvement des électrons, sont distants d'un longueur R :
1) On étudie en premier lieu le mouvement des électrons dans une configuration nucléaire donnée, où la distance internucléaire R est reconnue comme fixe (il est équivalent de dire que les deux noyaux sont fixes) ; l'approximation de Born-Oppenheimer consiste à dire que cette hypothèse apportera des solutions correctes, quoique non-exactes. On résout alors l'équation de Schrödinger pour les électrons en traitant R comme un paramètre. On obtient un ensemble 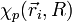 d'états propres pour le dispositif électronique, d'énergies Ep (R) . Les N électrons de la molécule sont repérés par leur rayon-vecteur
d'états propres pour le dispositif électronique, d'énergies Ep (R) . Les N électrons de la molécule sont repérés par leur rayon-vecteur 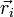 , où i = 1, 2, ..., N. Ces états forment une base de l'espace des états du dispositif électronique, nommée base adiabatique. On écrira qu'en fait, la fonction d'onde totale de la molécule se développe sur cette base. Au cours du calcul, on utilise une autre hypothèse, dite adiabatique, selon laquelle les électrons, particulièrement mobiles comparé aux noyaux, ajustent instantanément leur état aux variations de l'état du dispositif de noyaux.
, où i = 1, 2, ..., N. Ces états forment une base de l'espace des états du dispositif électronique, nommée base adiabatique. On écrira qu'en fait, la fonction d'onde totale de la molécule se développe sur cette base. Au cours du calcul, on utilise une autre hypothèse, dite adiabatique, selon laquelle les électrons, particulièrement mobiles comparé aux noyaux, ajustent instantanément leur état aux variations de l'état du dispositif de noyaux.
2) On étudie ensuite le mouvement des deux noyaux (rotation et vibration de "l'haltère" constituée par les deux noyaux), indépendamment de l'état du dispositif électronique. Un point important est que les énergies Ep (R) trouvées à la première étape apparaîtront comme un terme supplémentaire dans la partie d'énergie potentielle du hamiltonien du dispositif de noyaux. Cette étude ne relève plus directement de l'approximation de Born-Oppenheimer. Il ne faut cependant pas perdre de vue que l'étude de la vibration et de la rotation des molécules se fait dans le contexte préparé par cette approximation. Dans la pratique, tout ce qui est dit sur cette page se résume au fait que l'on étudie ensuite la rotation et la vibration d'une molécule dans un état électronique donné, représenté par une courbe d'énergie potentielle.
On considère une molécules constituée de deux atomes, A et B, de masse mA et mB, de numéro atomique ZA et ZB. Ces deux atomes apportent un total de N électrons, chacun de charge -q, repérés par un indice i. On a N = ZA + ZB si la molécule est électriquement neutre. Le calcul mené ci-dessous se place dans ce cas ; par exemple ZA est autant le nombre de protons du noyau de A que son nombre d'électrons. Le hamiltonien doit comporter l'énergie cinétique des noyaux TA et TB, l'énergie cinétique des électrons Te, l'énergie potentielle d'interaction électrostatique des noyaux entre eux VAB, des électrons entre eux Vee, des électrons et des noyaux VeAB. On a donc
où, avec 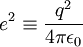
On se place désormais dans le référentiel du centre de masse G des noyaux, et on prend G pour origine des positions. Remarquons qu'il n'est pas précisément confondu avec le centre de masse de la molécule. L'énergie cinétique des noyaux dans le référentiel du laboratoire est , comme en mécanique classique, la somme de l'énergie cinétique du centre de masse dans ce référentiel et de l'énergie cinétique des noyaux dans le référentiel du centre de masse (RCM). On sait (voir un cours de mécanique classique) que dans le RCM, l'étude du mouvement des deux noyaux peut être ramené à celui du mobile fictif dont la position est donnée par 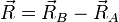 , et dont la masse est
, et dont la masse est 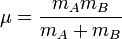
Dans le référentiel du laboratoire : 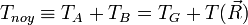
Dans le RCM : 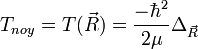
Les autres termes du hamiltonien ne sont pas modifiés dans le RCM, en se rappelant cependant que les positions sont désormais repérées comparé au centre de masse de A et B.
Equation de Schrödinger électronique
L'équation de Schrödinger dont la fonction d'onde totale 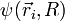 de la molécule est solution s'écrit
de la molécule est solution s'écrit
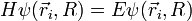
où, selon BO, les mouvements électronique et nucléaire sont découplés, et au sein du mouvement nucléaire les mouvements de rotation et de vibration le sont aussi :
E = Eelectronique + Evibration + Erotation
et
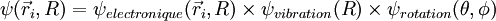
- L'approximation BO stipule que les noyaux sont fixes dans le RCM : Tnoy = 0
Dans le hamiltonien, il ne reste par conséquent plus que des termes électroniques : c'est un hamiltonien dont la solution est la fonction d'onde électronique 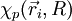 décrivant le dispositif d'électrons de la molécule :
décrivant le dispositif d'électrons de la molécule :
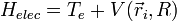
où on a rassemblé les termes d'énergie potentielle énumérés ci-dessus dans le terme 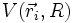 . Remarquons qu'on y a inclus (par convention) le terme de répulsion coulombienne des noyaux entre eux VAB. Ce n'est pas un terme d'énergie électronique, mais il est traité comme une constante puisque ne dépendant que de la distance entre noyaux qui est elle-même traitée comme un paramètre dans l'approximation de Born-Oppenheimer.
. Remarquons qu'on y a inclus (par convention) le terme de répulsion coulombienne des noyaux entre eux VAB. Ce n'est pas un terme d'énergie électronique, mais il est traité comme une constante puisque ne dépendant que de la distance entre noyaux qui est elle-même traitée comme un paramètre dans l'approximation de Born-Oppenheimer.
On a par conséquent 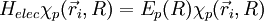
- On suppose que la fonction d'onde totale de la molécule se développe sur la base
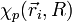 . Les cœfficients du développement sont notés
. Les cœfficients du développement sont notés 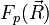 .
.
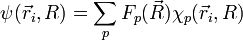
expression qu'on réinjecte dans l'équation de Schrödinger d'origine, avant l'hypothèse BO :
![\left[T_{noy}+H_{elec}\right]\sum_p F_p(\vec R)\chi_p(\vec r_i, R)=E\sum_p F_p(\vec R)\chi_p(\vec r_i, R)](illustrations/7a2813677a39e2ad5a6202178648ec6d.png)
donc par action de Helec :
![\left[T_{noy}+E_p(R)\right]\sum_p F_p(\vec R)\chi_p(\vec r_i, R)=E\sum_p F_p(\vec R)\chi_p(\vec r_i, R)](illustrations/9f3e9408b6f5f32ab3c14867b6462493.png)
expression qu'on projette sur une fonction 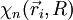 donnée de la base adiabatique :
donnée de la base adiabatique :
![\sum_p\int dˆ3r_1 ..
ˆ3r_N \chi_nˆ*(\vec r_i, R)T_{noy} \left[ F_p(\vec R)\chi_p(\vec r_i, R)\right ]+E_n(R)F_n(\vec R)=EF_n(\vec R)](illustrations/f18b774dee75da084f6f869920f14b29.png)
puisque la base adiabatique est orthonormée.
- Hypothèse adiabatique
On connaît l'action de 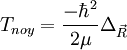 dans le RCM, donc :
dans le RCM, donc :
![T_{noy} \left[ F_p(\vec R)\chi_p(\vec r_i, R)\right ]=\frac{-\hbarˆ2}{2\mu}\Delta_{\vec R}\left[ F_p(\vec R)\chi_p(\vec r_i, R)\right ]](illustrations/5fb4edefbeb4aa3c6f60533419559acb.png)
i. e.
![T_{noy} \left[ F_p(\vec R)\chi_p(\vec r_i, R)\right ]=\frac{-\hbarˆ2}{2\mu}\left[ F_p(\vec R)\Delta_{\vec R}\chi_p(\vec r_i, R)+2\vec\nabla_{\vec R}F_p(\vec R)\vec\nabla_{\vec R}\chi_p(\vec r_i, R)+\chi_p(\vec r_i, R)\Delta_{\vec R}F_p(\vec R)\right ]](illustrations/20c0a8b11ab8acf135ad043b4f5bb6d7.png)
L'approximation adiabatique consiste à dire que les variations de la fonction d'onde électronique 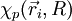 lors d'une petite variation de
lors d'une petite variation de 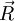 sont négligeables devant celles du cœfficient
sont négligeables devant celles du cœfficient 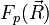 . Ainsi, les deux premiers termes de la somme ci-dessus sont négligés :
. Ainsi, les deux premiers termes de la somme ci-dessus sont négligés :
![T_{noy} \left[F_p(\vec R)\chi_p(\vec r_i, R)\right]=\frac{-\hbarˆ2}{2\mu}\left[\chi_p(\vec r_i, R)\Delta_{\vec R}F_p(\vec R)\right ]](illustrations/2859be14c97d5c1cecf7355ad7a6dee6.png)
- Réécrivons alors l'expression obtenue après projection sur χn, en tenant compte du calcul précédent :
![\sum_p\int dˆ3r_1 ..
ˆ3r_N \chi_nˆ*(\vec r_i, R)\frac{-\hbarˆ2}{2\mu}\left[\chi_p(\vec r_i, R)\Delta_{\vec R}F_p(\vec R)\right ]+E_n(R)F_n(\vec R)=EF_n(\vec R)](illustrations/273a7d653d9ee04a940b113f7ba4c16f.png)
et puisque la base adiabatique est orthonormée : 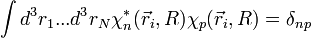 , donc :
, donc :
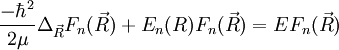
qu'on peut réécrire comme suit :
![\left[\frac{-\hbarˆ2}{2\mu}\Delta_{\vec R}+E_n(R)\right ]F_n(\vec R)=EF_n(\vec R)](illustrations/fb7f236c85dbc38e7516b4a9a7629420.png)
qui apparaît comme l'équation de Schrödinger dont 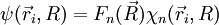 est solution, dans le cadre de l'hypothèse adiabatique (dans laquelle
est solution, dans le cadre de l'hypothèse adiabatique (dans laquelle 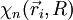 se comporte comme un scalaire multipliant
se comporte comme un scalaire multipliant 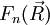 , sous l'action du laplacien. On peut par conséquent remplacer
, sous l'action du laplacien. On peut par conséquent remplacer 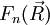 par
par 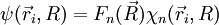 ).
).
Ainsi, l'approximation adiabatique a permis de ramener un état de la molécule, originellement décrit comme une superposition de fonctions de la base adiabatique, à une seule de ces fonctions.
Equation de Schrödinger nucléaire
Nous amorçons ici l'étude de la rotation et de la vibration de la molécule diatomique. Reprenons la dernière équation ci-dessus. Nous pouvons l'interpréter comme étant l'équation de Schrödinger nucléaire, où le terme d'énergie cinétique est bien celui du mobile fictif correspondant au mouvement relatif des noyaux (c'est l'énergie cinétique totale des noyaux dans le référentiel du centre de masse), et où la valeur propre En (R) du hamiltonien électronique joue le rôle d'une énergie potentielle dans ce hamiltonien nucléaire.
- Cette énergie est une fonction radiale, et les résultats relatifs au mouvement dans un potentiel central, obtenus habituellement dans l'étude quantique de l'atome d'hydrogène s'appliquent : on peut développer
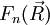 comme produit d'une fonction radiale et d'une fonction angulaire sous la forme
comme produit d'une fonction radiale et d'une fonction angulaire sous la forme
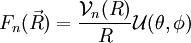
La fonction 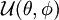 décrit la rotation de la molécule. La fonction
décrit la rotation de la molécule. La fonction 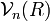 décrit la vibration de la molécule. En reportant l'expression de
décrit la vibration de la molécule. En reportant l'expression de 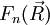 dans l'équation de Schrödinger et en écrivant l'action du laplacien (décomposé en partie radiale et partie angulaire), on obtient l'équation radiale dont
dans l'équation de Schrödinger et en écrivant l'action du laplacien (décomposé en partie radiale et partie angulaire), on obtient l'équation radiale dont 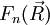 est solution et qui apporte les niveaux d'énergie de vibration, et l'équation angulaire dont
est solution et qui apporte les niveaux d'énergie de vibration, et l'équation angulaire dont  est solution et qui apporte les niveaux d'énergie de rotation. Les résultats obtenus pour la rotation et la vibration reposent sur le choix du potentiel électronique En (R) .
est solution et qui apporte les niveaux d'énergie de rotation. Les résultats obtenus pour la rotation et la vibration reposent sur le choix du potentiel électronique En (R) .
Conclusion
L'énergie totale de la molécule dans le référentiel du centre de masse apparaît in fine comme la somme de l'énergie électronique, de l'énergie de rotation de "l'haltère" constituée par les noyaux (rotateur rigide) et de l'énergie de vibration des noyaux (l'image correspondante est celle de "masses ponctuelles reliées par un ressort". En physique nucléaire, on parle aussi d'énergie de rotation et de vibration des noyaux, dans le cadre d'un modèle dit collectif ; le noyau y est reconnu comme un objet non ponctuel). On a par conséquent découplage de la rotation des noyaux, de la vibration des noyaux, et du mouvement des électrons. Ce résultat simple et important est la conséquence du l'approximation de Born-Oppenheimer. Ce modèle élémentaire est perfectionné en considérant par exemple le couplage de la rotation et de la vibration comme une perturbation au mouvement parfait découplé (distorsion centrifuge).
Voir aussi
Notes et références
- Mécanique Quantique, tomes 1 et 2 - Cohen Tannoudji, Diu, Laloë (Hermann)
- Physique Atomique, tome 2, seconde édition - Cagnac, Tchang-Brillet, Pebay-Peyroula (Dunod)
- Atoms and molecules : an introduction for students of physical chemistry - Karplus, Porter (Cummings Publishing Company)
- Physics of Atoms and Molecules - Bransden, Joachain (Prentice-Hall)
Liens externes
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 12/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

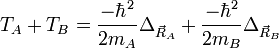
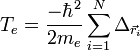
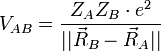
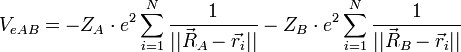
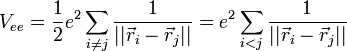

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité