Règle de Klechkowski
La règle de Klechkowski est une méthode empirique qui décrit l'ordre de remplissage des électrons dans les orbitales d'un atome.
Recherche sur Google Images :
Source image : forums.futura-sciences.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Dans l'état essentiel, quand plusieurs orbitales atomiques «dégénérées» (de... Règle de Klechkowski. L'ordre d'énergie croissante des orbitales atomiques est régi... On remarquera tandis que l'électron est dans la couche n = 1.... (source : fstm.ac)
- Pour n = 1 (première couche électronique électronique de H : état essentiel), ..... Dans l'état essentiel, quand plusieurs orbitales atomiques... Règle de Klechkowski. L'ordre d'énergie croissante des orbitales atomiques est régi... (source : ac-nancy-metz)
La règle de Klechkowski (aussi nommée règle de Madelung) est une méthode empirique qui décrit l'ordre de remplissage des électrons dans les orbitales d'un atome. Avec la règle de Hund et le principe d'exclusion de Pauli, elle forme l'un des outils de bases donnant la possibilité l'étude des orbitales atomiques dans le modèle de Bohr.
La règle de Klechkowski décrit que :
- «Les orbitales sont remplies de sorte que n + l soit croissant ;»
où n est le nombre quantique principal et l le nombre quantique secondaire. De plus,
- «En cas d'égalité, la sous-couche ayant le plus petit n est remplie en premier.»
Il existe cependant de nombreuses exceptions, liées aux stabilités spécifiques des orbitales saturées, qui préfèreront ainsi se compléter, au détriment éventuel d'autres couches déjà remplies. Les exceptions principales sont :
Pour ces atomes, et fréquemment pour des atomes proches susceptibles de former des ions isoélectroniques de ces atomes, on préfère écrire les configurations électroniques dans l'ordre réel des niveaux d'énergie, ce qui revient fréquemment à inverser les orbitales s et p de valence.
Représentation de la configuration électronique
Les orbitales sont représentées par leur nombre principal, n, et par une lettre représentant leur nombre secondaire l. Peut-être, on note les orbitales dégénérées en indice. Enfin, le nombre d'électrons sur l'orbitale est noté en exposant. On utilise :
- «s» pour l = 0 (de l'anglais : sharp) ;
- «p» pour l = 1 (principal) ;
- «d» pour l = 2 (diffuse) ;
- «f» pour l = 3 (essentiel) ;
- «g», «h»… (continuation de l'alphabet)
A titre d'exemple, l'orbitale n = 5, l = 3 contenant 14 électrons est notée : 5f¹². On peut écrire successivement l'ensemble des orbitales d'un atome en partant de la première 1s¹, mais on préfère le plus souvent partir d'un gaz noble. Pour le fer, on écrira indifféremment l'une des trois formules suivantes :
![\left[\mathrm{Fe} \right] = 1sˆ2 2sˆ2 2pˆ6 3sˆ2 3pˆ6 4sˆ2 3dˆ6](illustrations/2e46a7cde46fa2cb94661dfa2590cada.png) ; (forme complète)
; (forme complète) ![\left[\mathrm{Fe} \right] = \left[\mathrm{Ar} \right] 4sˆ2 3dˆ6](illustrations/223f2100c4068192871079ae0557f963.png) ; (forme abrégée rapportée à l'Argon)
; (forme abrégée rapportée à l'Argon) ![\left[\mathrm{Fe} \right] = \left[\mathrm{Ar} \right] 3dˆ6 4sˆ2](illustrations/7985091d9def232be08b32695a8067ab.png) . (forme abrégée classée par énergie)
. (forme abrégée classée par énergie)
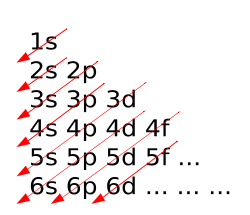
Diagramme de Klechkowski
Le diagramme de Klechkowski est un moyen mnémotechnique, servant à retrouver cette règle. On accède ainsi à l'ordre de remplissage des couches électroniques d'un élément chimique.
Sa construction est assez simple :
- Toutes les couches s sont mises en diagonale ;
- Puis on rajoute les couches suivantes (p, d, f, etc. ) sur la ligne.
La lecture se fait ensuite le long des colonnes. On trouve par conséquent l'ordre de remplissage suivant :
- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s…
Quelques exemples :
- Pour l'atome d'oxygène (Z = 8, soit 8 électrons à placer) : 1s2 2s2 2p4 ;
- Pour l'atome de cobalt (Z = 27, soit 27 électrons à placer) : 1s2 2s2 2p6 3s2 3p6 4s2 3d7.
Pour certains atomes, on préfère réarranger l'ordre des orbitales de sorte à ce qu'elles correspondent aux niveaux d'énergie croissant. Ainsi, la configuration du cobalt pourra aussi être décrite sous la forme :
- 1s2 2s2 2p6 3s2 3p6 3d7 4s2
Exceptions
Certains atomes ne respectent pas le principe de Klechkowski, surtout le cuivre, l'argent, l'or le chrome, le molybdène ou encore le palladium. En effet, dans ces atomes, on observe une couche d demi ou remplie, et une couche s dégarnie, tandis qu'elle devrait être totalement remplie. Un gain de stabilité des couches remplies et semi-remplie en est la cause.
Voir aussi
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité