Règle de Hund
En physique atomique, les règles de Hund se refèrent à un ensemble de règles simples utilisées pour déterminer quel est le terme spectroscopique essentiel de l'atome reconnu.

Catégories :
Règle scientifique - Chimie quantique - Physique quantique - Théorie chimique - Spectroscopie
Recherche sur Google Images :
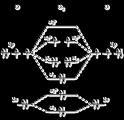
Source image : www.uel.education.fr Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- 30 messages - 8 auteurs - Dernier message : 6 août 2007 C'est en fait un atome de Fer qui a perdu un électron pour devenir un "ion... de remplissage (regle de hund) est complètement pleine ou complètement vide.... de haute énergie riche en azote, matériaux azoté de haute énérgie... (source : books.google)
- 9 messages - Dernier message : 4 nov 2005 Mais pour le Sc, le spin d'un seul électron d peut être aléatoirement alpha ou beta puisque dans les deux cas la première règle de Hund est ... (source : forums.futura-sciences)
En physique atomique, les règles de Hund se refèrent à un ensemble de règles simples utilisées pour déterminer quel est le terme spectroscopique essentiel de l'atome reconnu. Elles furent proposées par Friedrich Hund. En chimie, la première de ces règles est spécifiquement importante, et on se réfère fréquemment à elle seule sous le terme de "règle de Hund".
Les trois règles de Hund sont :
- Pour une configuration électronique donnée, le terme qui plus est faible énergie est celui maximisant le spin total (
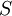 maximal).
maximal). - Pour un spin total donné, le terme qui plus est faible énergie est celui qui plus est grande valeur de
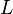 (moment cinétique orbital total).
(moment cinétique orbital total). - Pour un terme spectroscopique donné, dans un atome ayant sa couche externe à moitié pleine ou moins, le niveau qui plus est faible énergie est celui minimisant
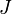 (nombre quantique lié au couplage spin-orbite). Dans un atome ayant sa couche externe plus qu'à moitié pleine, le niveau qui plus est faible énergie est celui de
(nombre quantique lié au couplage spin-orbite). Dans un atome ayant sa couche externe plus qu'à moitié pleine, le niveau qui plus est faible énergie est celui de 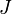 le plus élevé.
le plus élevé.
Ces règles montrent comment trouver de manière simple le terme spectroscopique essentiel. Elles supposent que le couplage spin-orbite est négligeable devant la répulsion des électrons de la couche externe, mais qu'il est aussi dominant comparé à l'ensemble des autres interactions non prises en compte. On parle alors de régime de couplage spin-orbite.
Les orbitales pleines ou les orbitales vides ne contribuent ni au spin total S, ni au moment cinétique orbitalaire total L. On peut montrer que dans ces cas là, le terme électrostatique résiduel (dû à la répulsion électronique) et le couplage spin-orbite, ne peuvent que déplacer en bloc l'ensemble des niveaux d'énergie. Par conséquent, on ne considère généralement que les électrons de valence pour ordonner les niveaux d'énergie.
Règle 1
En raison du principe d'exclusion de Pauli, 2 électrons ne peuvent partager les mêmes nombres quantiques dans le même dispositif. Ainsi, chaque orbitale spatiale ne peut abriter que 2 électrons, de spin opposé (respectivement un spin selon une direction arbitraire Z de 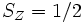 et
et 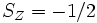 ). La première règle de Hund stipule que le plus bas niveau en énergie est celui maximisant la valeur de S, somme des spin respectifs de chaque électron se trouvant dans les orbitales de valence de l'atome. Ainsi, chaque orbitale est en premier lieu occupée par un seul électron, ayant tous le même spin, jusqu'à ce qu'apparaissent obligatoirement des paires.
). La première règle de Hund stipule que le plus bas niveau en énergie est celui maximisant la valeur de S, somme des spin respectifs de chaque électron se trouvant dans les orbitales de valence de l'atome. Ainsi, chaque orbitale est en premier lieu occupée par un seul électron, ayant tous le même spin, jusqu'à ce qu'apparaissent obligatoirement des paires.
Deux explications physiques ont été offertes (voir Levine p. 303-4) pour la stabilité accrue des états qui plus est haute multiplicité. Aux premier jours de la mécanique quantique, on a proposé que les électrons aux orbitales différentes sont plus éloignés les uns des autres, de sorte que l'énergie de répulsion entre électrons est réduite. Cependant cette explication est désormais périmée. Des calculs précis basés sur la mécanique quantique à partir des années 1970 démontrent plutôt que les électrons aux orbitales simplement occupés sont moins blindés du noyau, de sorte que ces orbitales se rétrécissent et l'énergie d'attraction entre électrons et noyau est augmentée.
Exemple
Considérons l'état essentiel de l'atome de silicium. La configuration électronique de Si est : 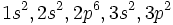 . Il nous faut considérer uniquement les électrons
. Il nous faut considérer uniquement les électrons 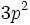 , pour lesquels on peut montrer que les termes spectroscopiques envisageables sont
, pour lesquels on peut montrer que les termes spectroscopiques envisageables sont 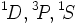 . La première règle de Hund dit tandis que le terme d'énergie la plus basse est
. La première règle de Hund dit tandis que le terme d'énergie la plus basse est 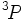 qui correspond à
qui correspond à 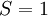 .
.
Règle 2
Cette règle vise aussi à minimiser l'énergie de répulsion entre électrons. Elle peut être comprise en utilisant l'ressemblance classique suivante : si l'ensemble des électrons orbitent dans une même direction (celle de moment cinétique orbitalaire le plus élevé), ils se rencontrent moins fréquemment que si certains d'entre eux orbitent dans des directions opposées. Dans ce cas la force de répulsion électrostatique augmente, ce qui sépare les électrons, ajoutant une énergie potentielle répulsive, et par conséquent augmentant l'énergie.
Exemple
Pour le silicium, il n'y a pas de choix de l'état triplet de spin 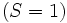 . La seconde règle n'est par conséquent pas utile. L'atome le plus léger requérant cette règle pour déterminer son terme qui plus est basse énergie est le titane (Ti, Z = 22) de configuration électronique 1s2 2s2 2p6 3s2 3p6 4s2 3d2. Cela conduit à 5 termes spectroscopiques dont 3 singulets (1S, 1D, et 1G) et 2 triplets (3P et 3F). On déduit de la première règle que le terme essentiel est un des deux triplets, et de la seconde règle que le terme essentiel est 3F (avec L = 3) plutôt que 3P (avec L = 1).
. La seconde règle n'est par conséquent pas utile. L'atome le plus léger requérant cette règle pour déterminer son terme qui plus est basse énergie est le titane (Ti, Z = 22) de configuration électronique 1s2 2s2 2p6 3s2 3p6 4s2 3d2. Cela conduit à 5 termes spectroscopiques dont 3 singulets (1S, 1D, et 1G) et 2 triplets (3P et 3F). On déduit de la première règle que le terme essentiel est un des deux triplets, et de la seconde règle que le terme essentiel est 3F (avec L = 3) plutôt que 3P (avec L = 1).
Règle 3
Cette règle prend en compte les différences d'énergie liées au couplage spin-orbite. Dans le cas où le couplage est faible devant les répulsions électrostatiques des électrons, 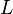 et
et 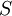 restent des nombres quantiques utilisables et la différence d'énergie est donnée par :
restent des nombres quantiques utilisables et la différence d'énergie est donnée par :
La valeur de 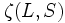 passe de +1 à -1 quand l'orbitale est plus que à moitié pleine. Ce terme donne la dépendance de l'état essentiel en énergie avec
passe de +1 à -1 quand l'orbitale est plus que à moitié pleine. Ce terme donne la dépendance de l'état essentiel en énergie avec 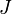 .
.
Exemples
Le terme qui plus est faible énergie du silicium, 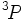 est dégénéré trois fois lorsque on néglige le couplage spin-orbite. Les valeurs de J quand on le prend en compte sont par conséquent
est dégénéré trois fois lorsque on néglige le couplage spin-orbite. Les valeurs de J quand on le prend en compte sont par conséquent 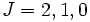 . Avec uniquement 2 électrons dans l'orbitale (qui peut en contenir 6), elle est moins que à moitié plein, et par conséquent le niveau d'énergie la plus basse est
. Avec uniquement 2 électrons dans l'orbitale (qui peut en contenir 6), elle est moins que à moitié plein, et par conséquent le niveau d'énergie la plus basse est 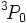 .
.
Pour le soufre (S), le terme qui plus est faible énergie est à nouveau 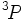 avec des valeurs de
avec des valeurs de 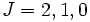 pour le couplage spin-orbite. Mais il y a désormais 4 électrons dans l'orbitale, le terme essentiel est par conséquent
pour le couplage spin-orbite. Mais il y a désormais 4 électrons dans l'orbitale, le terme essentiel est par conséquent 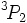 .
.
États excités
Les règles de Hund marchent mieux pour la détermination de l'état essentiel d'un atome ou molécule.
Elles sont aussi assez fiables (avec échecs occasionnels) pour déterminer l'état le plus bas en énergie d'une configuration électronique excitée donnée. Alors dans l'atome d'hélium, la première règle prédit quoique l'état triplet 1s2s (3S) est plus bas que le singulet 1s2s (3S). De même pour les molécules organiques, cette règle prédit que le premier état triplet (écrit T1 dans la photochimie) est plus bas que le premier état excité singulet (S1), ce qui est le plus souvent vrai.
Cependant les règles de Hund ne doivent pas être employées pour prévoir l'ordre des états autre que le plus bas état de chaque configuration. (Levine p. 303) A titre d'exemple, l'état essentiel de l'atome de titane possède une configuration 3d2, et l'application naïve des règles de Hund suggérerait l'ordre 3F < 3P < 1G < 1D < 1S. Mais en réalité l'état 1D est inférieure en énergie à 1G.
Signification physique
Deux aimants s'attirent quand ils sont de pôles opposés et se repoussent s'ils sont parallèles. Quand le champ terrestre l'emporte sur le champ d'un des aimants agissant sur l'autre, ils seront parallèles au champ magnétique environnant. Cela se produit quand ils sont suffisamment éloignés. Si on les rapproche, ils vont s'attirer et se retourner. Les électrons ont un moment magnétique proportionnel et de signe opposé au moment cinétique. Quand ils sont peu nombreux, ils sont éloignés sous l'effet de la répulsion électrostatique, comme indiqué plus haut; l'interaction magnétique est faible. Leurs moments magnétiques, par conséquent leurs spins, sont parallèles au champ magnétique environnant. Quand l'ensemble des orbitales d'une sous-couche sont occupées par un électron, les électrons supplémentaires devront avoir leurs moments magnétiques et leurs spins opposés pour vaincre la répulsion électrostatique, c'est le principe d'exclusion de Pauli. Le moment magnétique résultant étant alors nul, aucun électron n'est plus attiré dans l'orbitale; l'électron suivant se placera dans une autre orbitale jusqu'à ce que la sous-couche soit remplie.
Références
Ces références sont celles données par la version anglaise de cet article, et n'ont pas été vérifiées.
- Elementary Atomic Structure, physics, by G. K. Woodgate (McGraw-Hill, 1970) [ISBN 978-0198511564]
- G. L. Miessler and D. A. Tarr, Inorganic Chemistry (Prentice-Hall, 2nd edn 1999) [ISBN 0138418918], pp. 358-360
- T. Engel and P. Reid, Physical Chemistry (Pearson Benjamin-Cummings, 2006) [ISBN 080533842X], pp. 477-479
- I. N. Levine, Quantum Chemistry (Prentice-Hall, 4th edn 1991) [ISBN 0205127703], pp. 303-304
Voir aussi
- Principe d'exclusion de Pauli
- Règle de Klechkowsky
- Règle de l'octet
- Règle du duet
- Configuration électronique
Liens externes
Ces liens externes sont ceux donnés par la version anglaise de cet article, et n'ont pas été vérifiés.
- Hund's rules on HyperPhysics
- A glossary entry hosted on the web site of the Chemistry Department of Purdue University
- A PhysicsWeb article
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/04/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité